医疗器械CE标志
CE是欧盟强制性的要求,所有销往欧盟市场的产品都必须标示“CE”,当然对作为救死扶伤的医疗器械这一特殊用具而言也不例外。在欧洲,除了主管当局如工商检查者将检查上市的医疗器械是否带有CE标志,海关也将仅允许带有CE标志的产品通过边境。另外,医疗器械的使用者(医生、医院)在购买新器械时也会检查是否带有CE标志。显然,CE标志可作为器械在欧盟内的“通行证”。同时,一个医疗器械产品如果合法加贴了CE标志,也就表明:
1、 该医疗器械符合了欧盟医疗器械法规的基本要求;
2、 该医疗器械可以在欧盟市场内自由流通、销售及使用;
3、 该医疗器械的整个形成过程已通过了一个相应的符合性评价程序。
欧盟三个医疗器械指令
在医疗器械领域,欧盟委员会制定了三个欧盟指令,以替代原来各成员的认可体系,使有关这类产品投放市场的规定协调一致。
这三个指令分别是:
1.有源植入性医疗器械指令(AIMDD, 90/385/EEC),适用于心脏起搏器、可植入的胰岛素泵等有源植入性医疗器械。AIMDD于1993年1月1日生效。过渡截止期为1994年12月31日,从1995年1月1日起强制实施。
2.体外诊断器械指令(IVDD,98/79/EC),适用于肿瘤诊断试剂、血糖仪、妊娠检测装置等体外诊断用医疗器械。
3.医疗器械指令(MDD,93/42/EEC),适用范围最广,包括除有源植入性医疗器械和体外诊断器械之外的几乎所有医疗器械产品,如无源性医疗器械(伤口敷料、一次性使用无菌注射器、角膜接触镜、血袋、医用导管等)、有源医疗器械(如MRI核磁共振检查仪、超声诊断仪、输液泵、X射线机、电子血压计等)及植入性医疗器械(接骨钢板、螺钉、关节假体等)。该指令已于1995年1月1日生效,过渡截止日期为1998年6月13日,从1998年6月14日起强制执行。
上述指令规定,在指令正式实施后,只有带有CE标志的医疗器械产品才能在欧盟市场上流通销售。
医疗产品涉及到的欧盟指令
医疗器械指令 EC-Directive 93/42/EEC
1995年1月1日生效,1998年6月14日强制实施。注:2007/47/EC对该指令进行了修正
有源植入医疗器械指令EC-Directive 90/385/EEC
适用于心脏起搏器,可植入的胰岛素泵等 1993年1月1日生效,1995年1月1日强制实施。
体外诊断器械指令 EC-Directive 98/79/EEC
适用于血细胞计数器,妊娠检测装置等1998年12月7日生效,2003年12月7日强制实施
MDD指令中“医疗器械”的定义
[医疗器材]是指制造商预定用于人体以下目的的任何仪 器、装置、器具或其他物品,无论它们是单独使用还是组合使用,包括为其正常使用所需的软件:疾病的诊断、预防、监视、治疗或减轻损伤或残障的诊断、监视、治疗、减轻或修补解剖学和生理过程的探查,替换或变更-妊娠的控制
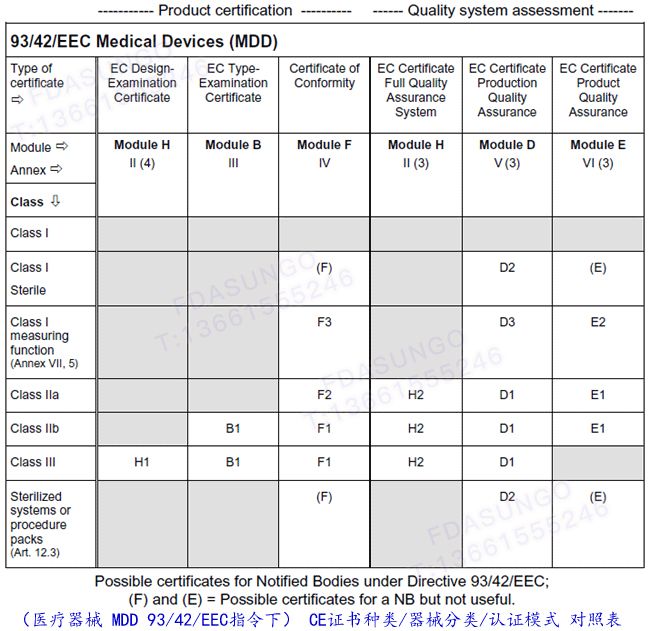
指令中医疗器械的分类
依据MDD指令,风险水平,产品分为I、IIa、IIb及III类
I类: 暂时使用(牙科压缩材料、检查手套)、绷带、病床等
I*类: 伤口贴、纱布片、灭菌检查用手套、血压表等
IIa类: 短期使用(导管、隐形眼镜)、暂时或短期使用(缝合针。外科手套)、给予或交换能量的治疗器械(肌肉刺激器、电钻、皮肤光疗机、助听器)、手术手套、输液器、B超等; 控制药物或其他物质进出人体的有源器械(吸引设备、供给泵)等
IIb类: 长期使用(正常牙线)、缝合线,骨钉、病人监护仪等、长期使用(假关节,眼内晶体)、如以一种潜在危险方式工作(麻醉机、呼吸机、透析机、高压氧舱); 一种潜在危险方式工作的(婴儿培养箱、高频电刀、超声碎石机、X光机)等
III类:可吸收缝合线,心脏瓣膜等、与中央循环系统(CCS)或中枢神经系统接触的器械等
III类医疗器械的CE认证步骤
1. 分类:确认产品属于III类医疗器械
2. 选择符合性评估途径
3. 编制技术文件
4. 委任欧盟授权代表
5. 从第三方公告机构(TUV莱茵、南德、SGS等)获得CE证书
6. (完成)CE符合性声明
7. 将技术文件存放在欧盟授权代表处(供欧盟主管机关随时检查)
8. 建立(售后)警戒系统/加贴CE标签并将产品投放EEA市场
(我公司专业办理CE技术咨询服务、技术文件整改,CE技术文件的编订,风险管理报告的编写,依据MEDDEV2.7.1Rev4编写的临床评估报告, 欧盟代表服务,欧盟自由销售证书CFS,美国FDA注册,FDA验厂辅导 等等 欢迎随时咨询 )
