一、背景
随着在MDR法规下欧洲医疗器械数据库(EUDAMED)各功能的逐步上线,欧盟在近期发布了关于欧洲医疗器械术语(EMDN)的常见问题指导,对EMDN做了进一步的解释。
EMDN是什么?
GMDN是什么?
EMDN与GMDN有什么区别呢?

二、GMDN
全球医疗器械术语系统(GMDN)是用于识别所有医疗器械产品的通用名称的目录。这包括在人体疾病或损伤的诊断、预防、监测、治疗或缓解过程中使用的产品。
GMDN 根据国际标准 ISO15225 编制,主要目的是向卫生当局和监管机构、医疗保健供应商、制造商和其他机构提供可用于交流医疗器械信息和支持患者安全的一套术语系统。
GMDN 适用于:
● 制造商、监管机构和医疗保健机构之间的数据交流
● 上市后警惕信息的交流
● 支持医院内部的库存控制
● 采购与供应链管理
目前GMDN 受国际医疗器械监管者论坛(IMDRF)推荐,已被70 多个国家的医疗器械监管机构用作支持其活动的术语系统。
GMDN由5位数字组成,会在网站、GMDN 数据库进行不定期更新,GMDN 代码表示的信息,可在精确定义的术语名称和定义中交叉引用,如本实例中所示:
GMDN 术语名称:一次性外科/医用口罩
GMDN 代码:35177
GMDN 定义:一一种灵活、宽松的面罩,设计用于放置在医护人员的嘴和/或鼻子上,以允许正常呼吸,同时保护患者和佩戴者免受大颗粒(例如,血液、体液和空气中的颗粒物质)的传播 ) 在医疗程序和患者检查期间; 它不是形状过滤装置(即不是呼吸器)。 它由柔软的多孔织物或纸质材料制成,通常使用弹性头带或领带固定; 它可能包含一个成形鼻架(金属丝)和/或透明的面罩/眼罩,旨在保护上面部/眼睛免受碎屑/液体的伤害。 这是一次性设备。
对 GMDN 数据库的访问根据组织规模定价。用户可以访问注册、申请术语变更并进行在线支付。
三、GMDN与MHRA注册
2018年,MHRA 按照现有欧洲单一市场指令的要求,对所有低风险器械注册强制使用 GMDN。在英国脱欧公投后,英国政府决定不采用新的欧盟医疗器械安全法规(MDR/IVDR),而是创建一个“动态的、适合未来的监管体系,能够适应未来的创新”。英国框架将在较长时期内继续认可现有的欧盟 CE 标志指令,以允许制造商过渡到仍在制定中的新英国法规。
MHRA已要求制造商从 2021 年 1 月 1 日起将其所有产品描述输入设备在线注册系统 (DORS),以便全面监管在英国市场上销售的设备。该数据库可供公众访问,注册成功的设备都可做查询。
GMDN 目前已用作英国范围内的医疗器械信息系统 (MDIS) 的一部分,将为医院、患者和供应商提供国家资源,以更好地识别和管理他们使用的医疗技术。
四、EMDN
EMDN在MDR及IVDR法规下,发挥着重要作用,除了用于在EUDAMED注册医疗设备,还将在EUDAMED中,与每个唯一的设备标识符-设备标识符(UDI-DI)相关联。
它前身为意大利的CND (Classificazione NazionaleDispositivi medici),最早在三个成员国(意大利、希腊和葡萄牙)中使用,并支持欧盟内各种欧盟和国际制造商的注册。
目前EMDN 的第一个版本已发布,根据MDR法规(EU)2017/745第26条和IVDR法规(EU)2017/746第23条,欧洲医疗器械命名法(EMDN)为欧洲医疗器械数据库(EUDAMED)提供支持。
由于EMDN主要用于支持MDR和IVDR的监管,因此它在MDR/IVDR设备文件和技术文件、由公告机构进行的技术文件取样、上市后监测、警戒和上市后数据分析中也发挥着关键作用等。它旨在支持所有参与者在MDR/IVDR下的活动,并向患者提供关键设备说明,包括他们自己的设备以及市场上所有其他设备,并在EUDAMED注册。
五、EMDN的主要原则
EMDN基于欧盟委员会和欧盟监管机构共同制定的基本关键原则。这些原则包括但不限于:
(a) 监管者主导:监管者在术语的管理、验证、更新和建议方面发挥着关键作用。
(b) 结构化:术语具有透明的层次结构,通过这些层次结构,术语和代码可以有意义地聚集到组和类型中。
(c) 可预测的:结构和内容保持足够稳定,以允许术语的各种监管用途,同时允许技术创新。
(d) 透明:术语和描述的更新政策是合理的,反映了监管机构和更广泛的医疗保健界的需求。
(e) 包容性:定期审查对所有人开放,以实际使用和可证明的需要为基础。
(f) 可用:所有用户都可以使用完整的术语、说明和代码。
(g) 无障碍:与其他运营商相比,任何制造商或自然人/法人在使用术语方面都不应收取费用或遭受任何歧视。
(h) 国际:在MDR/IVDR申请之日获得国际认可。
六、如何访问EMDN?
EMDN可免费在欧盟委员会的MDCG文件网页上访问和下载。
注:欧盟委员会就《欧洲医疗器械命名法》(EMDN)英文版举行了为期一个月的在线咨询,截止日期为2021年6月4日。目的是收集用户和广大医疗保健界对任何翻译错误和/或语法建议的反馈。在处理所提供的意见后,第二版EMDN将于2021年第3季度发布。此外,第二版将推出新的医疗器械软件术语和说明(J、W和Z类)。
七、EMDN的结构
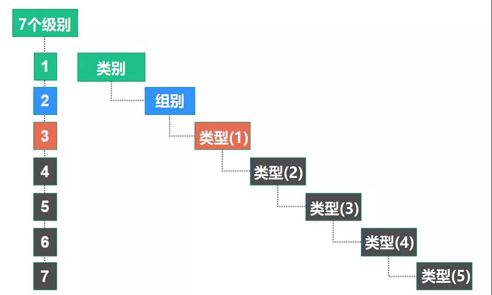
EMDN将医疗设备分为三个主要级别:
第一级别:类别
第二级别:群体
第三级别:类型——如必要时扩展为多个细节层次:(1)(2)(3)(4)(5)
如图所示:
每个字母数字代码以一个表示设备所属的“类别”的字母开头,后跟两个表示“组别”的数字和一系列表示“类型”的数字。最大位数设为13。
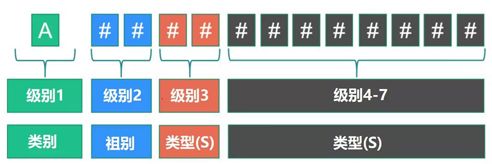
应该使用哪个级别的EMDN为设备分配术语?
使用 EMDN 的树状层次结构,用户必须始终将可用的最细粒度和终端术语(树中的最低级别)分配给他们的设备
八、GMDN or EMDN?
欧盟委员会决定不采纳 IMDRF 关于使用 GMDN 的指南,而是推广使用EMDN。在欧盟,新EUDAMED 设备数据库还处于测试阶段,这意味着使用GMDN在 EUDAMED 中对设备的准确识别目前属于“空窗期”,要到各功能逐步开放后才能更好地起到数据监管的功能。
而大多数其他 IMDRF 成员,包括美国、加拿大、澳大利亚、巴西和俄罗斯,都使用 GMDN,他们将从共享从大规模人口研究中获得的经验及数据,此外MHRA 未来可能会申请英国成为 IMDRF 的独立成员,从而促进更多国家/地区的准入。
在2021年5月28日至29日举行的世界卫生大会会议上,世卫组织秘书处被要求再次考虑他们的命名选择。世卫组织秘书处最近将其提案从创建新命名法改为采用当前的 EMDN 草案。
虽然所有国家都同意医疗器械命名法应该统一,但包括美国、俄罗斯、加拿大和英国在内的一些国家强烈建议WHO应使用 GMDN 作为监管机构使用的主要命名法。负责世卫组织关于通过 EMDN草案的提案的世卫组织负责药品和卫生产品获取的助理总干事表示:“世卫组织不会创建新的命名法,但将与现有的命名法合作,并与各国合作,从可用的那些中选择最有利于趋同的方法”。
如今全球化大环境下,对于医疗器械的监管分歧是不可取的,因为它引入了额外或重复的业务流程,也往往会增加分歧,而这一切最终只会转化为信息的不通畅、患者的风险和不必要成本增加。
因此,不管是GMDN还是EMDN,只要最终被广泛、规范的应用,都将会为医疗器械的发展做出积极的影响。

- 美国FDA
- 暂无标签
