近年来,随着人口老龄化进程的加快,适老化改造逐渐成为社会关注的热点话题。尤其在康复器械与病床类产品领域,适老化改造的重要性日益凸显。为满足老年人群体的特殊需求,市场对高质量、符合国际标准的康复器械和病床产品的需求日益增加。而在进入国内外市场时,获得CE、FDA认证及国内注册证已成为企业提升产品竞争力的关键步骤。 适老化改造的需求与挑战 随着年龄的增长,老年人在康复过程中对康复器械和病床类产品的要求也变得更加复杂和精细。这些产品不仅需要具备高标准的安全性与舒适性,还需结合老年人身体机能退化的特点,进行专门的适老化设计。例如,病床类产品需配备方便调节的床位高度、稳定的扶手以及安全的防滑设计,而康复器械则需确保操作简便、辅助支撑得当。
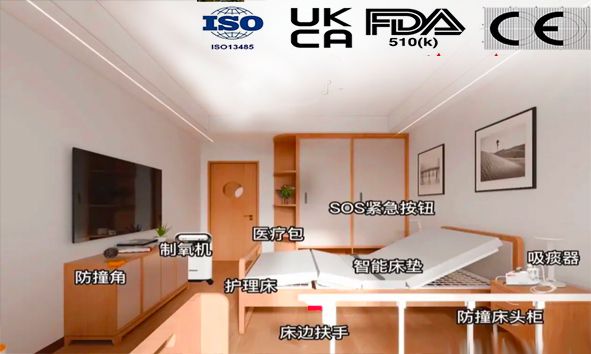
然而,如何确保这些产品在符合适老化要求的同时,也能顺利通过国内外严格的认证,成为了众多企业面临的一大挑战。
河北衡水代办CE、FDA及国内注册证服务——您的优质选择 在全球化的市场中,取得CE和FDA认证不仅是企业进入欧盟和美国市场的通行证,更是产品质量的象征。对于国内市场,取得医疗器械注册证更是产品合法销售的必经之路。为了帮助企业更高效地获得这些关键认证,河北衡水的专业代办团队应运而生。
1. 全方位的认证服务
无论是CE认证、FDA认证、ISO13485认证,还是国内医疗器械注册证,河北衡水代办团队都能够提供一站式服务。从文件准备、产品测试、标准符合性评估到最终的证书获取,我们的专家团队将全程为您把关,确保认证过程顺利高效。
2. 深厚的行业经验
我们的团队拥有丰富的医疗器械行业经验,深知适老化产品在认证过程中可能遇到的各种挑战。凭借对相关标准的深刻理解和对市场需求的敏锐把握,我们能够帮助企业提前规避潜在风险,确保产品快速通过认证。
3. 本地化优势与国际化视野
作为河北衡水本地的认证代办机构,我们不仅熟悉本地的市场环境和政策法规,还拥有与国际认证机构长期合作的经验。我们以本地化优势结合国际化视野,为企业提供最符合市场需求的认证方案。

把握适老化改造的风口,助力企业腾飞。
适老化改造是康复器械与病床类产品发展的新方向,也是企业提升市场竞争力的绝佳机会。
通过河北衡水专业的CE、FDA及国内注册证代办服务,您不仅能够确保产品的适老化设计符合最高标准,还能快速、高效地进入国内外市场,赢得更广阔的商机。
让我们携手,为老龄社会的康复事业贡献力量,共同迎接适老化改造带来的新机遇!
- 美国FDA
- 暂无标签

