电动轮椅和手动轮椅在美国FDA当中是属于FDA510K的产品。
电动轮椅、手动轮椅FDA510K认证办理流程是怎么样的?
轮椅及代步车在美国FDA中的分类,根据FDA的医疗器械监管分类,轮椅和代步车属于II类医疗器械,适用一般控制和特殊控制,并可能需要进行510(k)上市前通知。

II类医疗器械的审批途径
在FDA的监管框架下,II类医疗器械需满足一般控制要求,并可能需附加特殊控制措施,以保障产品的安全性与有效性。这些特殊控制通常包括:
符合安全标准:包括但不限于电池、电气和机械安全等。
提交测试报告:提供符合安全标准的测试数据。
注册与标签:制造商需在FDA注册,并在产品上贴有符合安全标准的标签。
质量体系符合性:建立和维护完善的质量管理体系(QMS)。
电动轮椅FDA510(k)认证办理流程
电动和手动轮椅出口至美国时,需进行FDA510(k)认证,具体流程如下:
信息准备:根据FDA法规,整理510(k)申请所需材料,包括产品图纸、规格、原材料清单及测试方案。
对比产品选择:根据产品说明书和手册,选定与申请产品等效的对比器械。
测试样品准备:提供测试样品,包括申请产品及对比产品。
DUNS编号申请:确保企业具有有效的DUNS编号。
测试工作:联系实验室,明确检测项目与要求,获取报价。
材料准备:根据510(k)申请清单,整理必要的资料。
客户支持:协助客户完善材料准备。
产品测试:由指定实验室对产品进行全面测试。
文件编写与递交:撰写完整的510(k)技术文件,并提交FDA审核。
FDA审核:
行政审核:确保文件符合申请要求。
技术审核(初次):FDA技术团队对产品进行技术审查。
技术审核(交互):针对反馈补充或修改文件。
批准时间:一般情况下,从申请到最终批准,整体周期为8-12个月。
办理周期说明
510(k)认证周期可分为以下几部分:
产品测试时间:根据测试标准决定,若已有CE认证,部分测试报告可直接采用。
技术文件编写:由专业团队完成完整的技术文件。
FDA审核时间:受FDA控制,一般需6-9个月。
申请所需材料
产品相关资料:
器械名称与类别;
产品用途声明;
器械标签与包装;
零部件清单;
与等效器械的对比资料。
测试相关资料:具体根据产品标准,由技术团队提供详细清单。
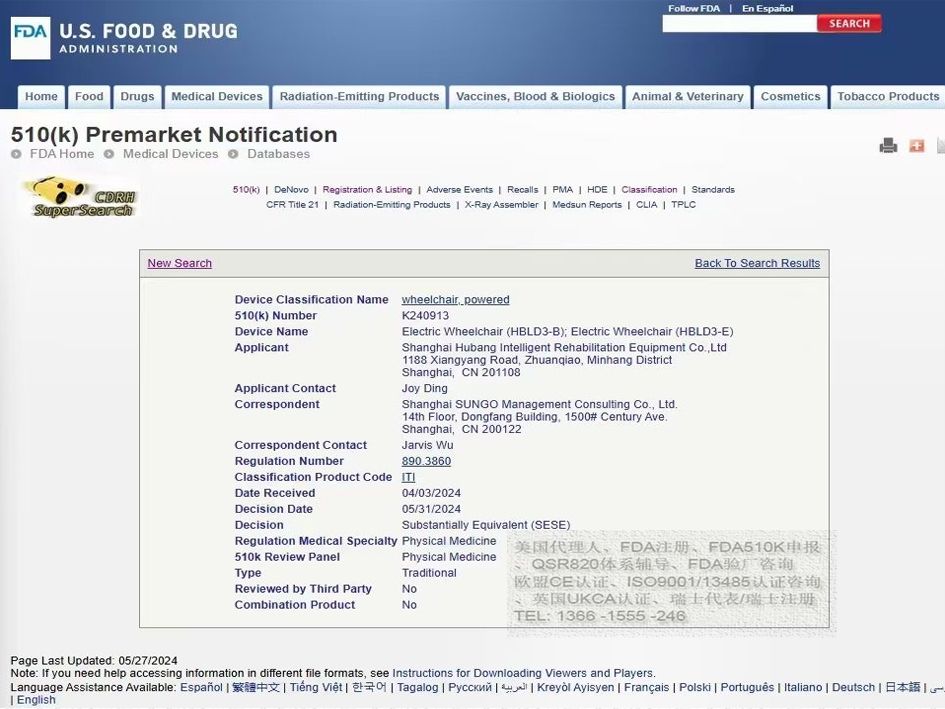
FDASUNGO为出口美国的企业提供以下支持:
美国代理人服务;
FDA注册与510(k)申报;
QSR820质量体系辅导;
FDA验厂咨询;
全套标准检测服务。
通过以上完整流程,企业可更快速高效地完成FDA510(k)认证,为产品进入美国市场提供强有力的保障。
- 美国FDA
- 暂无标签




