作为南美最大国家,巴西拥有2.14亿人口,代表了重要的市场增长机遇。过去三年的调查显示,巴西一直是医疗器械制造商的头号新兴销售市场。
相对于欧美国家,巴西上市周期较长,流程较为复杂,且语言不通畅,对国内制造商进军巴西造成了比较大的挑战。

巴西医疗器械分类
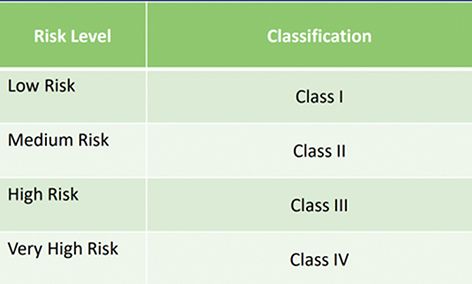
巴西医疗器械按照风险高低分为四类,其中一类风险最低,四类风险最高。分类规则,参考Resolution-RDC No.751/2022附录1共22个分类规则,分为四个类别:
非侵入性器械:
Rule 1-Rule 4
侵入性器械:
Rule 5-Rule 8
有源器械:
Rule 9-Rule 13
特殊规则:
Rule 14-Rule 22
巴西体外诊断器械分类-RDC 830/2023: 第二章
共8个分类规则:
Rule 1-Rule 7与IVDR分类规则趋于一致
Rule 8规定了“用于法定疾病检测的器械或国家卫生主管部门制定的专门法规中所列的器械属于3类,除非规则1-7中另有规定”
ANVISA医疗器械认证模式
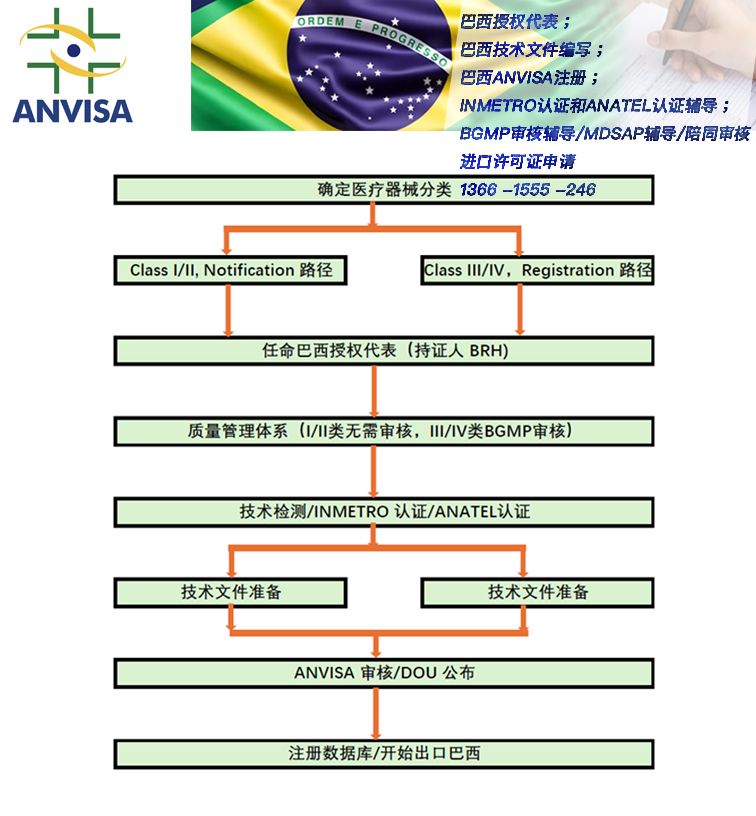
对于I/II类器械按照Notification认证模式:
监管途径:
不需要进行BGMP审核;
但是需要制造商按照BGMP建立企业的质量管理体系。
对企业的要求:
注册申请表;
BRH授权信;
ANVISA要求的其他资料;
编写符法规要求的技术文档;
委托持证人(BRH)在巴西注册(需提交技术文档给持证人),注册后即可销售。
III/IV类器械按照Registration认证模式:
监管途径:
必须获得巴西生产质量管理规范(BGMP)证书。若有MDSAP证书则可免除现场审核。
对企业的要求:
编制完整的技术文档,包括临床研究;
要求符合BGMP(巴西生产质量管理规范)BGMP证书是注册获批的前提之一;
由ANVISA进行审核;
审核通过后,获得合格评定证书;
委托持证人(BRH)在巴西注册(需提交技术文档给持证人),注册后即可销售。
巴西市场准入为什么选择FDASUNGO?
我们可以提供以下服务:
巴西授权代表;
巴西技术文件编写;
巴西ANVISA注册;
INMETRO认证和ANATEL认证辅导;
BGMP审核辅导/MDSAP辅导/陪同审核;
进口许可证申请。
- 美国FDA
- 暂无标签
